Wie weleens rondloopt in de haven van Scheveningen, weet het meteen: staal en zeelucht gaan niet goed samen. Tussen de viskotters, zeilschepen en offshore-pontons is overal roest te vinden. Of het nou gaat om relingen, rompen, bolders of kabels, overal zie je de roodbruine plekken die zich langzaam uitbreiden.
In een eerdere blog vroegen we ons af waarom een schip eigenlijk niet zinkt, maar vandaag gaan we een stapje verder. Want hoewel een schip netjes kan blijven drijven, wordt het nog steeds aangetast door de omgeving. Hoe gaan scheepsbouwers hiermee om? En wat is roest nou eigenlijk?

Wat is roest?
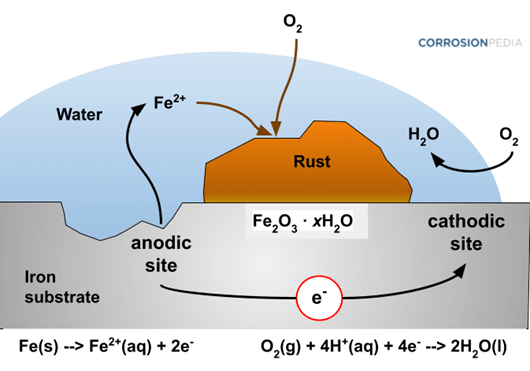
Roest ontstaat door een chemisch proces waarbij ijzer of staal oxideert door contact met water en zuurstof. Het metaal keert dan langzaam terug naar zijn oorspronkelijke staat als ijzererts. Tijdens deze elektrochemische reactie verandert het oppervlak in een poreuze, roodbruine laag die zwak is, en verdere aantasting zelfs versnelt. Roest ontstaat vooral in vochtige omgevingen en wordt extra versneld door zout water of zure omstandigheden, zoals bijvoorbeeld in de haven van Scheveningen. Het is dan dus ook niet gek om schepen te zien, die ónder de roest zitten.
Op microscopisch niveau ontstaat roest door een redoxreactie. IJzer-atomen staan elektronen af (oxidatie) en zuurstofmoleculen nemen deze elektronen op (reductie), in aanwezigheid van water.
- Wanneer een ijzeren oppervlak wordt blootgesteld aan vochtige lucht, verliest het ijzer elektronen:
- Fe → Fe²⁺ + 2e⁻
- Zuurstof in water neemt de vrijgekomen elektronen op, waarbij hydroxide-ionen ontstaan:
- O₂ + 4e⁻ + 2H₂O → 4OH⁻
- De ijzerionen (Fe²⁺ ) en de hydroxide-ionen (OH⁻) reageren samen tot ijzer(II)hydroxide (Fe(OH)₂). Dit oxideert verder tot ijzer(III)hydroxide (Fe(OH)₃). Na opdroging, is dit roest: Fe₂O₃ · xH₂O
Roest is poreus en biedt geen bescherming. Integendeel: het laat lucht en vocht gemakkelijk door, waardoor het roestproces zich dieper in het metaal kan vreten. Hoe sneller roestvorming wordt onderbroken of voorkomen, hoe beter.
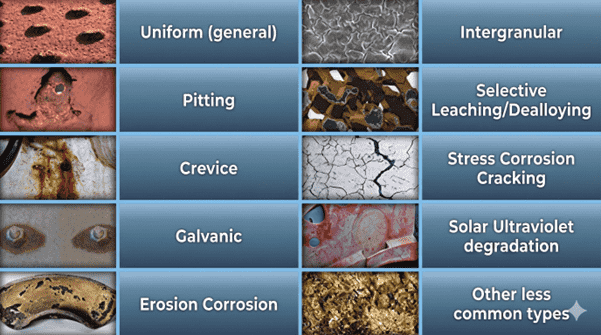
Verschillende vormen van roestvorming
Er zijn verschillende vormen van roestvorming, afhankelijk van het soort metaal, de omgeving en de constructie. Een aantal veelvoorkomende vormen zijn:
- Uniforme corrosie (oppervlakteroest) – Hierbij wordt het hele oppervlak geleidelijk aangetast. Er ontstaat een egale laag roodbruine roest, die goed te behandelen en voorspelbaar is
- Putcorrosie – Kleine, scherpe ‘putjes’ in het metaaloppervlak, die vaak pas laat opgemerkt worden. Deze vorm komt veel voor bij roestvast staal (RVS) in contact met chloride (zoals zeewater of pekel). Dit vreet in de diepte zonder veel zichtbare schade aan het oppervlak.
- Spleetcorrosie – Als vocht lang blijft hangen in nauwe kiertjes of overlapping, kan hier roest optreden. Dit gebeurt bijvoorbeeld bij lasnaden, flensverbindingen of onder pakkingen. Dit soort verborgen plekken zijn gevoelig voor lokale aantasting.
- Galvanische corrosie (contactcorrosie) – Ontstaat als twee verschillende metalen (elektrisch) contact maken in aanwezigheid van een elektrolyt (bijvoorbeeld water). Het ‘minder edele’ metaal fungeert als anode en corrodeert sneller. Dit zie je vaak bij bijvoorbeeld aluminium (hier de anode) op stalen frames (hier de kathode). Dit kan voorkomen worden met goede isolatie, zoals met kunststof ringen of een coating.
- Interkristallijne corrosie – Een zeldzame, maar gevaarlijke vorm waarbij corrosie langs de korrelgrenzen van het metaal loopt, vooral bij slecht verwerkte RVS-lassen. Het oppervlak lijkt soms nog intact, terwijl de structuur van binnenuit wordt aangetast.
- Spanningscorrosie – Combineert trekspanningen in het metaal met een chemisch agressieve omgeving. Dit kan leiden tot plotselinge breuk, zelfs zonder zichtbare schade. Komt voor bij bijvoorbeeld roestvast staal onder mechanische belasting in chloorhoudende omgevingen.
Waarom is roest een probleem?
Roest is niet alleen lelijk; het vreet zich letterlijk door staal heen. Draagbalken, remleidingen, scharnieren, machineframes kunnen bij roestvorming dusdanig structureel aangetast worden, dat de veiligheid direct gevaar loopt. Eén zwakke plek kan een heel systeem onderuit halen.
Corrosie en roestvorming zijn wereldwijde geldverslinders. Schade door roest loopt in de miljarden euro’s per jaar, volgens schattingen van onder andere NACE en ISO-corrosierapporten. Daarbij gaat het niet alleen om vervanging van onderdelen, maar ook om stilstand, extra arbeid en veiligheidsmaatregelen.
In sectoren als offshore, automotive en infrastructuur vormt roest directe risico’s. Denk aan een brug met stalen kabels die jarenlang zijn blootgesteld aan condens en pekel, of een schip waarvan de romp van binnenuit is aangetast. In beide gevallen geldt: als je roest negeert, speelt het met mensenlevens.
Hoe voorkom je roest?
De beste manier om roest te voorkomen, is door het metaal te beschermen tegen vocht en zuurstof. Hier zijn een aantal verschillende manieren voor.
- Verf en coating – Met een verflaag kun een barrière vormen die lucht en water buitenhoudt. Industriële coatings bevatten vaak pigmenten die corrosie tegengaan en zijn bestand tegen mechanische belasting.
- Galvaniseren (verzinken) – Door m.b.v. dompelverzinken een zinklaag aan te brengen op staal, oxideert het zink in plaats van het ijzer. Het zink offert zichzelf namelijk op, waardoor het onderliggende staal niet wordt aangetast. Deze techniek wordt vooral veel toegepast op constructiedelen, bouten en moeren.
- Roestvast staal (RVS) – Door legering met chroom vormt zich een beschermend oxidelaagje, dat betere bescherming tegen chloridehoudende omgevingen, zoals in de maritieme sector.
- Rubberen afdichtingen of kunststofringen – Isoleren van verschillende metalen, m.b.v. kunstof scheidingslagen of ringen voorkomt galvanische erosie.
- Vet en waxlagen – Vooral voor voertuigen wordt onder de carrosserie vaak een vet- of waxlaag aangebracht, die in naden en voegen kruipt. Dit biedt langdurige bescherming, zelfs bij pekel en opspattend water.
Wat als er al roest is?
Helaas is roest niet altijd te voorkomen… Als er al roest is gevormd, stopt het niet vanzelf. Er moet dan ingegrepen worden, en ook daar zijn een aantal verschillende methodes voor:
- Mechanisch verwijderen – Schuren, borstelen of stralen met zand of glasparel, verwijdert de losse roestlagen, zoals te zien in de onderstaande afbeelding. Zo kom je weer bij het blanke metaal.
- Chemisch behandelen – Roestomvormers met fosforzuur of tannine zetten ijzeroxide om in stabiele ijzerverbindingen, waarna het oppervlak opnieuw kan worden beschermd met verf of lak.
- Kruipolie – Kruipolie of roestoplossers wordt gebruikt bij vastzittende delen; ze dringen door in de schroefdraad en helpen onderdelen los te krijgen. Ook hitte kan hier erg effectief bij zijn.

Innovaties in roestpreventie
Er zijn de afgelopen jaren verschillende innovatieve manieren ontwikkeld om roestbestrijding effectiever en duurzamer te maken. Een goed voorbeeld daarvan is de zink-aluminium-magnesiumcoating (ZM-coating). Dit type verzinking biedt verbeterde bescherming, onder andere door het zelfherstellende effect dat ook na beschadiging nog bescherming biedt. ZM-coating wordt steeds vaker toegepast in profielen, gevelsystemen en installatiedelen.
Ook is er gewerkt aan speciale nanocoatings: superdunne, waterafstotende lagen (vaak op basis van silanen of fluorpolymeren) die vocht weren zonder de structuur of kleur van het materiaal te veranderen. Deze coatings zijn populair voor high-end elektronica, architectuur en automotive detailing.
Naast de nanocoatings, zijn er ook speciale lakken ontwikkeld met microcapsules die bij beschadiging actieve stoffen vrijlaten. Dit zijn bijvoorbeeld corrosieremmers of harsen, waardoor de beschadiging zich als het ware automatisch sluit.
En tot slot de opofferingsanodes, die o.a. in de scheepvaart worden gebruikt. Dat zijn zink- of aluminiumblokken bevestigd aan staal om corrosie te voorkomen. Deze blokken offereb zich op zodat het staal intact blijft. Dit kan ook gedaan worden met een externe stroombron (impressed current) voor langdurige toepassingen.
Conclusie
Roestpreventie is niet alleen een kwestie van kosten of gemak, maar ook van duurzaamheid. Elk onderdeel dat je niet hoeft te vervangen, bespaart grondstoffen en energie. Hierbij kun bijvoorbeeld je de levensduur van een machine, een constructie of voertuig met vijf tot tien jaar verlengen. Innovaties zoals ZM-coatings of nanotechnologie dragen daar sterk aan bij. Zouden er in de toekomst nog extra manieren bijkomen voor roestpreventie?
Robert Dilber
Bronnen:
- Galvano van Wolferen – “Wat is roest precies en hoe kun je het voorkomen?”
- ZRC Worldwide – “What causes rust in metals?”
- Metaltek International – “What Is Rust And How To Prevent It”
- Robert Dilber – Kennis opgedaan tijdens de materiaalkundevakken
- Tractor Forum – Afbeelding verroeste olietapplug
- Corrosionpedia – Afbeelding roestvorming
- Whole Building Guide Design, upscaled met Gemini – Afbeelding verschillende typen roest
- Daitool – Afbeelding roest mechanisch verwijderen
